OFTALMOLOGIA
Cura e prevenzione per la tua vista
Dott.ssa Sara Trovarelli
Dopo anni di studio e duro lavoro, ho iniziato a praticare la professione di Oculista come professionista nel 2012.
La mia vasta conoscenza medica, unita alla continua curiosità di conoscere le ultime novità del settore hanno segnato il mio successo in campo medico.
Mi sono laureata all’Università degli Studi di Trieste, sono iscritta all’Ordine dei Medici di Trieste num 3951. Ho conseguito la Specializzazione in Oftalmologia all’Università degli studi di Trieste successivamente ho effettuato 1 anno di Dottorato di ricerca sull’Ambliopia ( Oftalmologia Pediatrica) presso IRCCS Burlo Garofolo. Sono socia AIMO ( Associazione Italiana Medici Oculisti). Ho effettuato anche diversi master in Rehfractive Surgery presso ESASO Lugano.
Ricevo in diversi studi:
A Trieste:
- Studio Medico Tergeste,
- Fisiomed Italia.
Chirurgo presso le seguenti strutture:
Gemona: Sanitas Friuli
Monastier di Treviso: CdC Giovanni XXIII
Codroipo: Friulmedica
PATOLOGIE TRATTATE
Cataratta
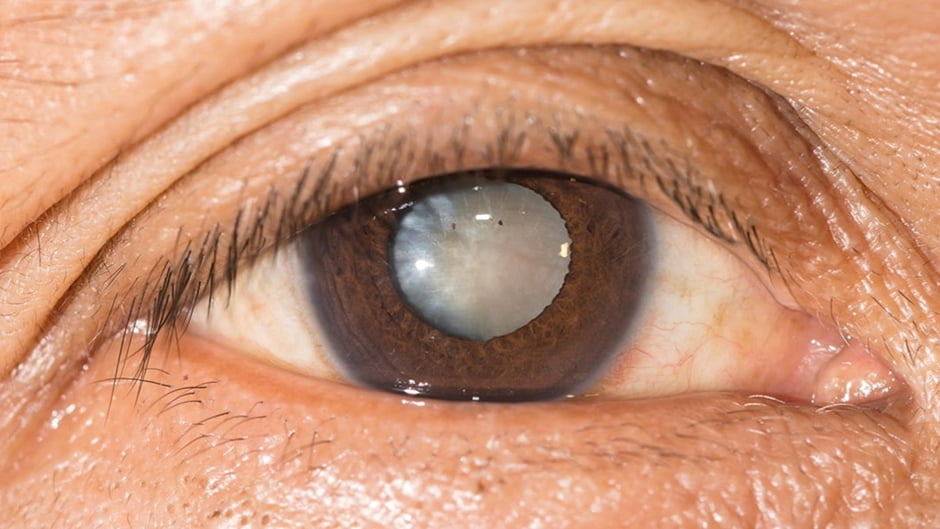
La cataratta è un’opacizzazione del cristallino, la lente naturale che si trova all’interno dell’occhio, tra l’iride e il corpo vitreo, una sostanza gelatinosa che riempie il bulbo oculare.
Cause principali della cataratta
Le cause più comuni della cataratta sono legate a modifiche nella composizione chimica del cristallino, in particolare l’ossidazione delle sue proteine, che riducono la sua trasparenza. Le cause principali includono:
- Invecchiamento: Il processo naturale di senescenza del cristallino è il principale responsabile, portando alla cataratta senile, il tipo più comune;
- Diabete: Può accelerare l’opacizzazione del cristallino;
- Carenze nutrizionali: In particolare la mancanza di vitamine e antiossidanti;
- Fattori genetici: Difetti ereditari o congeniti;
- Esposizione a radiazioni ionizzanti: Come quelle dovute a trattamenti medici;
- Traumi oculari: Danni fisici che colpiscono il cristallino.
Inoltre, uno stile di vita malsano, come il fumo, una dieta povera e la mancanza di attività fisica, potrebbe accelerare l’insorgere della cataratta, anche se gli studi scientifici su questo punto non sono del tutto concordi.
Il ruolo dell’invecchiamento
Il normale invecchiamento porta all’indurimento e all’opacizzazione del cristallino, con il passare degli anni. Nei bambini, la cataratta può essere congenita, spesso causata da infezioni o infiammazioni durante la gestazione. In alcuni casi, la cataratta può insorgere prematuramente, a partire dai 40 anni, e viene chiamata cataratta giovanile.
I traumi oculari possono causare la cataratta a qualsiasi età, e l’uso di alcuni farmaci, come i cortisonici, può favorirne lo sviluppo.
Sintomi comuni della cataratta
I sintomi principali sono:
- Visione offuscata, come se si guardasse attraverso un vetro smerigliato;
- Visione doppia e fotofobia (ipersensibilità alla luce);
- Abbagliamento e percezione dei colori meno vivida;
- Necessità di cambiare frequentemente la prescrizione degli occhiali.
In alcuni casi, la presbiopia (difficoltà a vedere da vicino) può migliorare temporaneamente a causa di una miopizzazione progressiva del cristallino, rendendo la visione da vicino più chiara.
Diagnosi della cataratta
La diagnosi viene effettuata tramite una visita oculistica completa, in cui l’oculista esamina il cristallino per determinare il tipo, la posizione e le dimensioni dell’opacità. A seconda della zona colpita, la cataratta può essere nucleare (centrale), corticale (periferica) o sottocapsulare (posteriore).
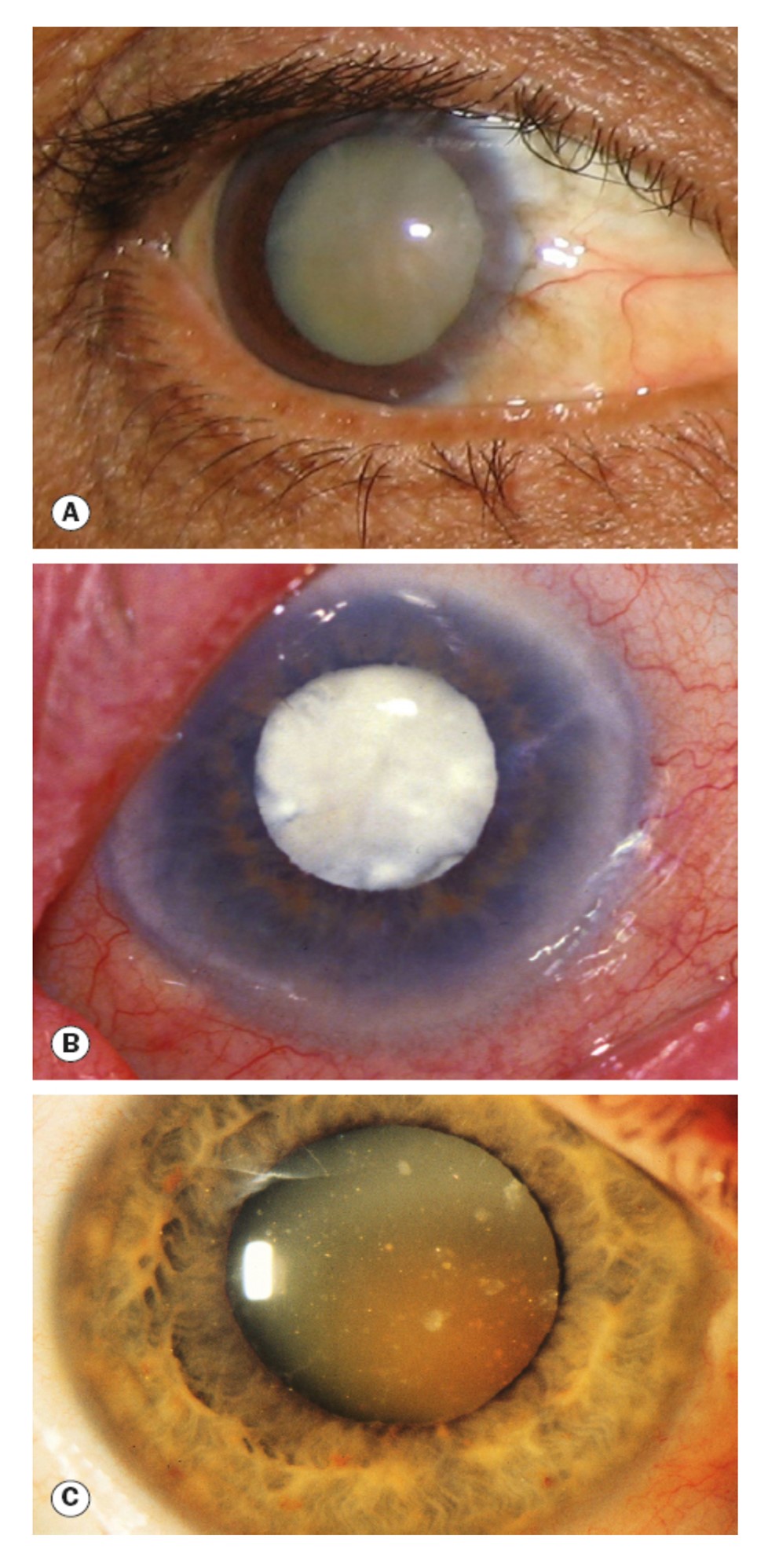
Trattamento della cataratta
L’unico trattamento per la cataratta è chirurgico, ed è generalmente eseguito con la facoemulsificazione, una tecnica che utilizza ultrasuoni per frantumare il cristallino e aspirarlo. Viene poi impiantata una lente artificiale (IOL).

Il recupero post-operatorio è rapido grazie alle incisioni minori e alle tecniche moderne. Recentemente, il laser a femtosecondi è stato introdotto per rendere l’intervento ancora più preciso e meno traumatico.
Quando intervenire?
L’intervento è necessario quando la cataratta provoca un deficit visivo che compromette la qualità della vita o quando l’opacizzazione peggiora progressivamente, aumentando i rischi operatori. In alcuni casi, l’intervento può portare benefici aggiuntivi, come la riduzione della pressione intraoculare nei pazienti con glaucoma.
Complicanze dell’intervento
Anche se le complicanze sono rare (circa 0,01%), possono includere l’aumento temporaneo della pressione oculare, secchezza oculare, edema maculare, distacco della retina o miodesopsie (corpi mobili nel corpo vitreo). Tuttavia, le tecniche moderne hanno ridotto notevolmente questi rischi.
Cura post-operatoria
Dopo l’intervento, è importante evitare di sfregare l’occhio e dormire sul lato operato. Si devono seguire le indicazioni del medico, usare i colliri prescritti e proteggere gli occhi da polvere e sostanze irritanti. L’utilizzo di occhiali da sole è raccomandato per proteggere dalla sensibilità alla luce. Il follow-up regolare con l’oculista è essenziale per monitorare la guarigione e prevenire infezioni.
Frequenza della cataratta
La cataratta è molto comune, soprattutto nelle persone anziane. In Italia, colpisce circa l’8,5% della popolazione tra i 70 e i 74 anni, e aumenta con l’età, raggiungendo il 17,1% oltre gli 80 anni. È la principale causa di cecità e disabilità visiva nel mondo, ma con un trattamento adeguato è quasi sempre reversibile.
Cataratta secondaria
La cataratta secondaria è un’opacizzazione della capsula posteriore del cristallino, che può svilupparsi dopo l’intervento chirurgico. Si manifesta nel 25-30% dei casi a due anni dall’operazione. Il trattamento prevede un intervento laser ambulatoriale per rimuovere l’opacizzazione.
Prevenzione della cataratta
Sebbene non sia possibile prevenire completamente la cataratta, è possibile ridurre il rischio tramite uno stile di vita sano, evitando fumo, esposizione al sole senza protezione e una dieta equilibrata. Alcuni studi suggeriscono che il trattamento di patologie come diabete e ipertensione può ridurre il rischio di cataratta. L’efficacia dei complementi vitaminici nella prevenzione resta controversa.
Glaucoma
Il glaucoma è una malattia oculare progressiva e irreversibile che danneggia le cellule nervose della retina e il nervo ottico, compromettendo la visione. Questa condizione è legata all’aumento della pressione intraoculare e può causare danni permanenti se non trattata tempestivamente. La perdita della visione, inclusa l’ipovisione, può essere prevenuta con diagnosi precoce e trattamento adeguato. Il glaucoma è considerato una patologia neurodegenerativa che coinvolge la morte delle cellule ganglionari retiniche.
Epidemiologia
Il glaucoma è una delle principali cause di cecità, con una prevalenza del 3,5% tra i 40 e gli 80 anni per il glaucoma ad angolo aperto e dello 0,5% per quello da chiusura d’angolo. Circa 76 milioni di persone sono affette a livello mondiale, e in Italia colpisce un milione di persone, ma metà di esse non è consapevole della malattia a causa della mancanza di controlli regolari. L’incidenza varia in base all’etnia: più comune negli afroamericani per il glaucoma ad angolo aperto e nelle popolazioni asiatiche per quello da chiusura d’angolo.
Fattori di rischio
- Pressione intraoculare: È il fattore principale per lo sviluppo del glaucoma, ma non tutti i pazienti con alta pressione oculare svilupperanno la malattia. È fondamentale monitorare la pressione oculare regolarmente.
- Età: Il rischio aumenta con l’età, specialmente oltre i 40 anni, e la prevalenza cresce con l’invecchiamento della popolazione.
- Etnia: Le persone di etnia afro-americana hanno un rischio maggiore di glaucoma ad angolo aperto, mentre le popolazioni asiatiche sono più colpite dal glaucoma da chiusura d’angolo.
- Familiarità: I parenti di primo grado di chi ha il glaucoma sono più vulnerabili alla malattia.
- Miopia moderata/elevata e diabete: Entrambi possono aumentare il rischio di glaucoma.
- Ipertensione e ipotensione sistemica: Sono legate all’incidenza del glaucoma.
- Spessore corneale ridotto: Sebbene non sia un fattore di rischio indipendente, contribuisce allo sviluppo della malattia.
- Altri fattori di rischio per glaucoma da chiusura d’angolo: Età avanzata, familiarità, sesso femminile, ipermetropia.
Come si produce l’aumento della pressione oculare?
All’interno dell’occhio, l’umore acqueo è continuamente prodotto e riassorbito. Quando il canale di deflusso è ostruito, si verifica un aumento della pressione intraoculare, che può danneggiare il nervo ottico, in particolare la papilla ottica nella zona centrale della retina. Questo danno, se non trattato, diventa irreversibile e può compromettere la visione, motivo per cui è fondamentale un trattamento tempestivo per prevenire danni permanenti.
Come si produce il danno alla vista?
L’immagine che vediamo è trasmessa dalla retina al cervello tramite il nervo ottico, che contiene milioni di fibre, ognuna delle quali trasporta una parte dell’immagine. L’aumento della pressione oculare danneggia questi neuroni, causando la morte delle cellule ganglionari retiniche. Questo interrompe la comunicazione tra i fotorecettori e il cervello, determinando una progressiva perdita di campo visivo, che inizia dalla periferia. Se il glaucoma non viene trattato, la visione centrale si deteriora, portando a una riduzione dell’acuità visiva fino alla cecità. Poiché il danno è irreversibile, è fondamentale un intervento tempestivo per evitare danni permanenti.

Sintomi della pressione oculare alta
Il glaucoma, tranne nella forma acuta, si sviluppa senza sintomi evidenti. Quando il paziente nota difficoltà nella visione periferica, i danni al nervo ottico sono già in atto. Sebbene la visione centrale resti spesso intatta, il visus può essere perfetto, ma si manifestano difficoltà in attività che richiedono la visione laterale, come scendere le scale o guidare.
I sintomi che possono comparire con la pressione alta oculare includono:
- Dolore agli occhi, soprattutto sopra il sopracciglio
- Occhi arrossati
- Mal di testa
- Vista offuscata
- Aloni intorno alle luci
- Nausea e vomito
- Midriasi
- Fotofobia
- Lacrimazione
Il termine “glaucoma” si riferisce a un gruppo di patologie oculari di diversa origine, con caratteristiche cliniche variabili. Per semplificare la classificazione, i glaucomi possono essere suddivisi in due categorie principali: i glaucomi ad angolo aperto e quelli da chiusura d’angolo. Queste due categorie si differenziano in modo significativo sia nel meccanismo patogenetico che nel decorso della malattia.
Glaucoma primario ad angolo aperto (POAG)
Il glaucoma primario ad angolo aperto è la forma più comune di glaucoma nei paesi occidentali. È caratterizzato da un angolo irido-corneale di dimensioni normali, ma con un aumento della pressione intraoculare (IOP). I principali fattori di rischio per questa condizione sono una pressione intraoculare elevata e l’avanzare dell’età. La causa esatta del danno retinico nel POAG non è completamente chiara. Si ritiene che un’elevata pressione intraoculare, insieme a fattori vascolari, possa danneggiare le cellule ganglionari retiniche e i loro assoni, alterando il normale trasporto assonale. L’aumento della pressione intraoculare è generalmente causato da una maggiore resistenza a livello del trabecolato, la struttura dell’occhio che gestisce il deflusso dell’umor acqueo. Questo aumento di resistenza, dovuto a fattori come l’età, lo stress ossidativo o cause non completamente comprese, impedisce un corretto drenaggio del fluido oculare, aumentando così la pressione interna dell’occhio. Esiste una distinzione tra i POAG a pressione elevata e quelli a pressione normale. Nel caso di questi ultimi, i pazienti presentano livelli di pressione oculare considerati normali (solitamente inferiori a 20 mmHg) ma hanno caratteristiche cliniche particolari. Si ritiene che in questi casi, fattori di rischio diversi dall’aumento della pressione intraoculare possano avere un ruolo importante nel determinare l’insorgenza e il peggioramento della malattia. Tuttavia, il trattamento rimane invariato.
POAG sospetto e ipertensione oculare
Non sempre gli esami strumentali e le visite riescono a determinare con certezza se un paziente sia affetto da glaucoma. In alcuni casi, soprattutto nelle fasi iniziali della malattia, i pazienti vengono classificati come sospetti per glaucoma. Questi pazienti presentano alcuni segni che potrebbero indicare la presenza della malattia, come alterazioni del nervo ottico, modifiche nel campo visivo, pressione oculare borderline o misurazioni OCT anomale. Tuttavia, nessuno di questi segni è sufficientemente significativo o coerente da confermare una diagnosi. Solo il tempo e la ripetizione degli esami, data la natura progressiva del glaucoma, possono chiarire la situazione. Il medico stabilirà se è necessario un trattamento basato sui dati disponibili e sui fattori di rischio del paziente. I soggetti con pressione oculare superiore ai limiti considerati normali (maggiore di 21 mmHg) ma senza danni visibili al nervo ottico o al campo visivo, e senza altri fattori di rischio, sono definiti come affetti da ipertensione oculare. Avere una pressione oculare alta non implica necessariamente la presenza di glaucoma. Anche in questo caso, il medico deciderà se è necessaria una terapia e programmerà controlli periodici per monitorare l’evoluzione della condizione.
Glaucomi secondari ad angolo aperto
I glaucomi secondari ad angolo aperto costituiscono un gruppo di patologie in cui, oltre alla presenza di un angolo irido-corneale aperto e di danni al nervo ottico, esiste una causa chiara che spiega lo sviluppo della malattia. I principali tipi di glaucoma secondario vengono brevemente descritti di seguito.
Glaucoma pseudoesfoliativo
Il glaucoma pseudoesfoliativo (PEX) è il tipo più comune di glaucoma secondario ed è associato alla sindrome pseudoesfoliativa, o PEX. Questa condizione è caratterizzata dalla produzione di un materiale furfuraceo da parte della superficie del cristallino, che si esfolia e ostruisce il trabecolato, l’area responsabile del drenaggio dell’umore acqueo. Ciò porta a un aumento della pressione intraoculare. Inoltre, il materiale furfuraceo può depositarsi sulle fibre zonulari, che ancorano il cristallino al corpo ciliare, provocando un indebolimento di queste fibre e una possibile dislocazione del cristallino. L’oculista può rilevare la PEX durante l’esame obiettivo utilizzando la lampada a fessura, specialmente con la pupilla dilatata, per osservare i depositi circolari di materiale furfuraceo sulla superficie anteriore del cristallino.
Caratteristiche del glaucoma pseudoesfoliativo
Generalmente, il glaucoma pseudoesfoliativo colpisce entrambi gli occhi in modo bilaterale, ma spesso in modo asimmetrico. I pazienti possono presentare una pressione oculare elevata, che può variare considerevolmente nell’arco delle 24 ore, e la condizione tende a evolversi rapidamente. È anche più comune lo sviluppo di cataratta, e si osserva una maggiore incidenza di complicanze durante o dopo l’intervento di cataratta. Inoltre, la dilatazione pupillare risulta più difficile.
Trattamento del glaucoma pseudoesfoliativo
Il trattamento iniziale per il glaucoma pseudoesfoliativo è di tipo farmacologico, con colliri ipotonizzanti per ridurre la pressione intraoculare. Se i risultati non sono soddisfacenti, si possono adottare terapie più aggressive, eventualmente combinando farmaci diversi. Il trattamento laser (trabeculoplastica) può dare buoni risultati, anche se non sempre duraturi. In alcuni casi, è necessario intervenire chirurgicamente con una trabeculectomia. Se è presente una cataratta, è consigliato eseguire una facoemulsificazione, che può abbassare la pressione intraoculare in modo significativo, oltre a semplificare eventuali interventi chirurgici successivi, come la trabeculectomia.
Glaucoma pigmentario
Il glaucoma pigmentario è associato alla sindrome da dispersione di pigmento, in cui una particolare conformazione di strutture intraoculari libera pigmento nell’umor acqueo, alterando la funzione del trabecolato e causando un aumento della pressione intraoculare. Questo tipo di glaucoma è più comune negli uomini sopra i 30 anni. Il riconoscimento della condizione è generalmente facile per l’oculista, che valuterà la necessità di terapia.
Altri glaucomi secondari ad angolo aperto
Altri tipi di glaucoma secondario includono:
- Glaucoma uveitico, che si sviluppa a seguito di uveiti infettive o non infettive.
- Glaucoma neovascolare, che è una complicanza di malattie vascolari oculari o retinopatia diabetica avanzata.
- Glaucoma causato da alterazioni del cristallino, come traumi o cataratte ipermature.
- Glaucoma post-traumatico.
- Glaucoma post-chirurgico.
- Glaucoma da farmaci, in particolare in seguito a trattamenti cortisonici prolungati.
Glaucomi da chiusura angolare
Si tratta di un insieme di patologie caratterizzate da un aumento della pressione intraoculare, causato dal contatto tra la periferia dell’iride e il trabecolato, con conseguente ostacolo al deflusso dell’umor acqueo. Questa condizione può portare a manifestazioni cliniche di varia entità, dal glaucoma acuto a episodi intermittenti di chiusura angolare.
Il principale meccanismo responsabile è il blocco pupillare, che si verifica in circa due terzi dei casi e impedisce il normale passaggio dell’umor acqueo attraverso la pupilla. Tuttavia, la chiusura angolare può essere innescata anche da anomalie dell’iride (iris plateau), alterazioni del cristallino, modificazioni della struttura posteriore dell’occhio, uso di determinati farmaci o precedenti interventi chirurgici oculari.
Nel mondo occidentale, i glaucomi da chiusura angolare sono meno comuni rispetto ad altre forme, ma possono rappresentare una minaccia significativa per alcuni soggetti a rischio, come gli ipermetropi. Durante le visite oculistiche, è fondamentale che l’oculista valuti la predisposizione a questa condizione, poiché esistono procedure preventive efficaci. Tecniche laser (iridotomia YAG) o interventi chirurgici, come l’estrazione della cataratta con finalità idrodinamiche, possono ridurre o eliminare il rischio di una futura chiusura angolare. Tra le possibili manifestazioni di questa condizione, la più evidente è la chiusura angolare acuta, descritta di seguito.
Chiusura angolare acuta
Si tratta di un evento clinico improvviso e severo, caratterizzato da un marcato aumento della pressione intraoculare (superiore a 50 mmHg). I sintomi principali includono dolore oculare intenso, cefalea frontale, riduzione della vista, nausea e vomito. L’esame oculistico rivela segni distintivi, come pupilla dilatata, edema corneale, arrossamento e marcata riduzione della profondità della camera anteriore.
Essendo un’emergenza oftalmologica, richiede un intervento immediato per evitare danni permanenti alla vista. Il trattamento prevede la somministrazione di farmaci per abbassare la pressione intraoculare e l’esecuzione di una iridotomia YAG laser o, nei casi più complessi, di un intervento chirurgico mirato a rimuovere il blocco della chiusura angolare.
Glaucoma congenito
Questa forma di glaucoma è presente sin dalla nascita a causa di un’anomalia congenita nel sistema di drenaggio dell’occhio, che determina un aumento della pressione intraoculare. I segni principali includono fotofobia (ipersensibilità alla luce), eccessiva lacrimazione e, nei casi più avanzati, un aumento delle dimensioni dell’occhio dovuto alla minore resistenza delle pareti oculari nei neonati. Inoltre, la cornea può apparire opaca.
Qualsiasi sintomo sospetto deve spingere i genitori a consultare tempestivamente un oculista per una visita approfondita. Sebbene sia una patologia rara, con un’incidenza di circa un caso ogni 10.000 neonati, una diagnosi precoce è essenziale per preservare la funzione visiva.
Diagnosi del glaucoma
§L’unico metodo per una diagnosi precoce del glaucoma consiste in una visita oculistica approfondita. Prima di iniziare l’esame vero e proprio, l’oculista raccoglie i dati anamnestici del paziente per comprendere eventuali sintomi e verificare la presenza di casi di glaucoma in famiglia, poiché la componente ereditaria gioca un ruolo chiave nello sviluppo della patologia.
Di seguito, vengono descritti i principali esami diagnostici e di follow-up per i pazienti con glaucoma o a rischio di svilupparlo.
Visita oculistica
La visita oculistica permette di esaminare le strutture oculari coinvolte nella progressione della malattia. Tra gli aspetti valutati vi sono:
L’ampiezza della camera anteriore, determinante nei casi di glaucoma da chiusura d’angolo.
La presenza di possibili cause di glaucoma secondario, come la sindrome pseudoesfoliativa, la dispersione di pigmento o la neovascolarizzazione.
L’aspetto della testa del nervo ottico e la possibile presenza di danni glaucomatosi.
L’esame include anche la valutazione del fondo oculare, preferibilmente con dilatazione della pupilla (midriasi). La frequenza delle visite di controllo varia tra i 3 e i 12 mesi, in base alla gravità della malattia e alla sua progressione. Poiché il glaucoma è una patologia cronica e irreversibile, il monitoraggio costante è essenziale per individuare tempestivamente eventuali peggioramenti e adottare le opportune terapie.
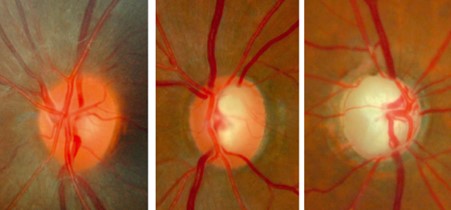
Misurazione della Pressione Oculare (Tonometria)
La misurazione della pressione intraoculare è un esame cardine della diagnosi e del monitoraggio del glaucoma. Lo strumento di riferimento è il tonometro ad applanazione di Goldmann, che consente una misurazione accurata e indolore dopo l’applicazione di un collirio anestetico e di fluoresceina.
Esistono anche metodi alternativi, come il tonometro a soffio e il tonometro a rimbalzo, che non richiedono anestesia. In alcuni casi, può essere utile monitorare la pressione più volte al giorno attraverso una curva tonometrica, per ottenere una valutazione più dettagliata delle variazioni della pressione intraoculare.
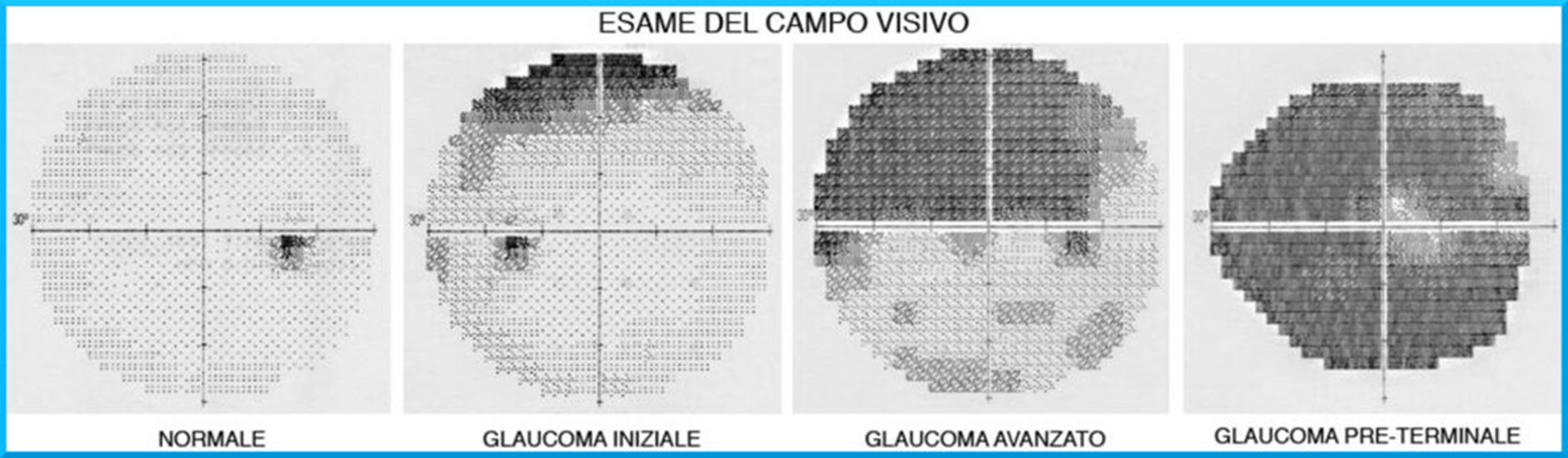
Esame del campo visivo
L’esame del campo visivo è fondamentale per la diagnosi e il follow-up del glaucoma, poiché permette di rilevare eventuali deficit nella percezione dello spazio circostante. Il danno glaucomatoso comporta una progressiva riduzione del campo visivo, spesso prima che il paziente ne avverta i sintomi.
L’esame, eseguito con strumenti chiamati perimetri, consiste nella proiezione di stimoli luminosi su uno sfondo chiaro; il paziente deve segnalare la percezione degli stimoli premendo un pulsante. La precisione dei risultati dipende dalla capacità del paziente di collaborare e concentrarsi, per cui potrebbero essere necessari più tentativi per ottenere un test attendibile. Come la visita oculistica, l’esame del campo visivo deve essere ripetuto periodicamente secondo le indicazioni dell’oculista.
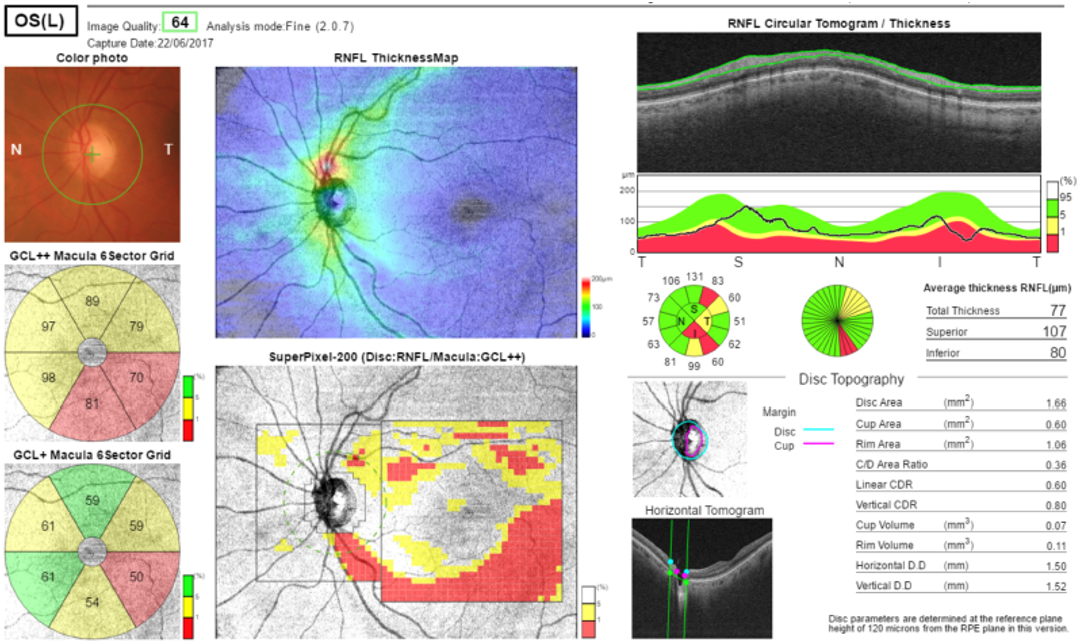
Tomografia a Coerenza Ottica (OCT)
L’OCT (Tomografia a Coerenza Ottica) è un esame non invasivo che fornisce immagini ad alta risoluzione delle strutture oculari coinvolte nel glaucoma. È un valido strumento complementare alla visita oculistica e all’esame del fondo oculare, in quanto permette di monitorare con estrema precisione l’evoluzione del danno glaucomatoso. La periodicità dell’esame è stabilita dall’oculista in base alla progressione della malattia.
Pachimetria
La pachimetria misura lo spessore corneale, un parametro importante nella valutazione del glaucoma. Questo esame, che può essere eseguito con strumenti a contatto o senza contatto con la superficie dell’occhio, dovrebbe far parte della valutazione iniziale di tutti i pazienti glaucomatosi o sospetti tali.
Uno spessore corneale ridotto rappresenta un fattore di rischio per lo sviluppo del glaucoma, mentre un valore anomalo può influenzare la misurazione della pressione intraoculare: cornee sottili tendono a sottostimarla, mentre cornee spesse la sovrastimano.
Gonioscopia
La gonioscopia è l’esame che permette di osservare direttamente l’angolo irido-corneale, la struttura deputata al drenaggio dell’umor acqueo, il liquido intraoculare che influisce sulla pressione oculare. Nei glaucomi da chiusura d’angolo, questa regione risulta ridotta, compromettendo il deflusso del liquido e favorendo l’aumento della pressione intraoculare.
Per eseguire la gonioscopia, si applica una lente specifica sulla superficie dell’occhio dopo aver instillato un collirio anestetico, permettendo l’osservazione dell’angolo irido-corneale alla lampada a fessura. Questo esame dovrebbe essere eseguito almeno una volta in tutti i pazienti con glaucoma o a rischio, in particolare nei soggetti predisposti al glaucoma da chiusura d’angolo.
Conclusione
La diagnosi e il monitoraggio del glaucoma richiedono un approccio multidisciplinare che comprende diversi esami oculistici. Poiché il glaucoma è una malattia cronica e irreversibile, sottoporsi a controlli regolari è fondamentale per prevenirne la progressione e preservare la vista il più a lungo possibile.
Secondo le attuali linee guida, l’obiettivo della terapia del glaucoma non è semplicemente la riduzione della pressione oculare, ma il miglioramento della qualità di vita del paziente glaucomatoso o a rischio di glaucoma, a un costo sostenibile per la società. La decisione su quale terapia utilizzare e quando iniziarla deve essere personalizzata per ogni paziente, poiché non solo la malattia, ma anche la terapia stessa ha un impatto sulla qualità della vita e sui costi sanitari. Attualmente, il medico oculista non può guarire il danno glaucomatoso una volta che si è manifestato, ma può rallentarne la progressione riducendo la pressione oculare fino a un valore ideale specifico per ogni paziente (IOP target). Questo valore consente di limitare la riduzione delle cellule ganglionari retiniche a un livello fisiologico simile a quello dell’invecchiamento naturale. Le opzioni terapeutiche per contrastare la progressione del glaucoma includono la terapia medica, quella laser e quella chirurgica.
La terapia medica si basa sull’instillazione quotidiana di colliri contenenti farmaci specifici. Le principali classi di farmaci utilizzate sono gli analoghi delle prostaglandine, i beta-bloccanti, gli inibitori dell’anidrasi carbonica, gli alfa-2 agonisti, i parasimpaticomimetici e gli inibitori delle rho chinasi, categoria più recente. In casi selezionati e nel breve termine, possono essere impiegati anche farmaci con diversa modalità di somministrazione, come il mannitolo, un diuretico osmotico somministrato per via endovenosa, o l’acetazolamide in compresse. Ogni classe farmacologica ha un profilo specifico in termini di efficacia e possibili effetti collaterali, con una riduzione della pressione oculare che varia dal 20% fino al 35-40% per singolo principio attivo. La terapia può essere combinata per raggiungere la IOP target. Affinché la terapia sia efficace, il medico deve responsabilizzare il paziente sull’importanza della costanza nel trattamento e sulla gestione degli eventuali effetti collaterali. Inoltre, il paziente deve essere in grado di autosomministrarsi correttamente il collirio o riceverne la somministrazione da un caregiver. Se la terapia medica non è ben tollerata o non riesce a impedire la progressione della malattia, si valuta l’opzione chirurgica.
La terapia laser comprende la trabeculoplastica laser selettiva (SLT) e la trabeculoplastica con argon laser (ALT). Questi trattamenti non richiedono ospedalizzazione, possono essere eseguiti in ambulatorio e permettono una riduzione media della pressione oculare fino al 25%. Possono essere utilizzati come unico trattamento o in associazione con terapia medica o chirurgica, ma non sono indicate per i glaucomi ad angolo chiuso, infiammatori o neovascolari. La terapia laser è utile anche per il trattamento dell’attacco acuto di glaucoma: in caso di blocco pupillare, un’iridotomia YAG laser permette di ripristinare la normale idrodinamica tra la camera posteriore e anteriore dell’occhio.
Ciclofotocoagulazione Laser per glaucoma
Trattamento laser non chirurgico, non invasivo per il glaucoma con impiego di un innovativo sistema laser micropulsato.
La Ciclofotocoagulazione Laser MP3 rappresenta una importante ed innovativa forma di trattamento del glaucoma. Tale procedura laser ha lo scopo di ridurre i livelli di pressione oculare in pazienti affetti da glaucoma. L’MP3 Laser è un nuovo laser a diodi, che emette un treno di onde laser frazionate in micro impulsi che vengono diretti dalla sonda laser sui corpi ciliari oculari del paziente. I corpi ciliari sono i responsabili della eccessiva produzione dell’
Come viene eseguito il trattamento laser?
Al paziente comodamente sdraiato sul lettino viene applicato un collirio anestetico. Si inizia quindi il trattamento laser che consiste nel fare gentilmente scivolare una sonda laser sui bordi oculari adiacenti alla cornea. Il trattamento copre sia l’emisfero superiore che inferiore oculare e l’intero trattamento non richiede più di qualche minuto.
Chi è candidato ideale a questo trattamento laser MP3?
Il trattamento del glaucoma con il Laser Iridex MP3 MicroPulsato permette di ridurre la pressione oculare sia in pazienti affetti da glaucoma, che non risponde in modo adeguato alle terapie tradizionali, sia l’impiego in pazienti compensati come pressione oculare, ma che male sopportano i colliri e ne desiderano una minor dipendenza. Il laser MP3 trova quindi applicabilità per tutti i pazienti con glaucoma, che rientrano nelle categorie qui sotto descritte.
- pazienti con una pressione oculare non sufficientemente ben controllata con le terapie in atto
- pazienti che non tollerano bene le terapie antiglaucomatose in atto
- pazienti che non riescono a instillare i colliri in modo regolare come prescritto
- pazienti già sottoposti ad altri trattamenti per glaucoma ed ancora scompensati
- pazienti che fisicamente non tollerano la terapia importante prescritta e necessaria.
Il Laser MicroPulsato MP3 può essere quindi utile in un numero molteplice di situazioni. In pazienti che non possono assumere per vari motivi la terapia prescritta, la pressione può essere tenuta sotto controllo e la terapia rimpiazzata. In altri casi il trattamento laser serve come coadiuvante alla terapia data e permette così al paziente di continuare a svolgere le normali attività senza sottoporsi ad un intervento chirurgico importante.
La chirurgia rappresenta la soluzione nei casi in cui le terapie conservative non siano sufficienti. La trabeculectomia, considerata il gold standard, prevede la creazione di una fistola tra la camera anteriore dell’occhio e lo spazio sotto la congiuntiva per favorire il drenaggio dell’umore acqueo tramite una bozza filtrante. Nei casi più complessi, si possono impiantare valvole o tubi drenanti, indicati quando la chirurgia tradizionale ha fallito o è a rischio di insuccesso a causa della cicatrizzazione della bozza filtrante. Altre tecniche chirurgiche includono la sclerectomia profonda, la viscocanalostomia e la canaloplastica, che sono meno invasive della trabeculectomia ma presentano un’efficacia ipotonizzante inferiore.
Le tecniche MIGS (minimally invasive glaucoma surgeries) rappresentano un’alternativa meno invasiva, utilizzando dispositivi che facilitano il deflusso dell’umor acqueo bypassando il trabecolato, dilatando il canale di Schlemm o creando uno spazio di deflusso sottocongiuntivale. Questi interventi comportano minore manipolazione chirurgica, un recupero più rapido e un ridotto tasso di complicanze, ma l’efficacia ipotonizzante è generalmente inferiore rispetto alla trabeculectomia. Sono solitamente riservate ai pazienti che non necessitano di una drastica riduzione della pressione oculare. La scelta del trattamento va sempre attentamente personalizzata in base al quadro clinico e spetta al chirurgo valutare l’opzione più adatta.
Infine, anche la chirurgia della cataratta può contribuire alla riduzione della pressione oculare nei casi di glaucoma da chiusura angolare indotta dal cristallino, rappresentando un’opzione terapeutica aggiuntiva nei pazienti selezionati.
La pressione intraoculare (Faq)
Da cosa è determinata la pressione degli occhi?
La pressione intraoculare (IOP) è determinata dalla quantità di un liquido prodotto all’interno dell’occhio chiamato “umor acqueo”. Ovviamente più liquido c’è nel bulbo oculare più è alto il valore della pressione stessa.
Con quale unità si misura?
Il valore della pressione interna dell’occhio, sebbene sia differente dalla pressione arteriosa, si misura con la stessa unità, ossia in “millimetri di mercurio” (mmHg). Mentre l’oculistica tradizionale considerava i due valori del tutto distinti (indipendenti), recenti studi hanno messo in evidenza l’esistenza di una correlazione (per quanto essa possa essere debole): secondo alcuni ricercatori con una pressione arteriosa elevata ci sarebbero maggiori probabilità di soffrire di pressione intraoculare elevata.
Qual è il valore massimo tollerabile dall’organismo?
La pressione intraoculare deve essere normalmente compresa tra i 10 e i 20 millimetri di mercurio (mmHg). Il glaucoma è generalmente associato a valori superiori a 20-21 mmHg, ma esiste anche una forma di glaucoma a bassa pressione in cui vengono prodotti danni al nervo ottico (pur con valori pressori compresi nei limiti normali) che sembra dipendere da uno scarso afflusso di sangue al nervo ottico, il quale a sua volta provoca la progressiva atrofizzazione delle fibre nervose. Inoltre bisogna tenere conto anche dello spessore della cornea e dell’eventuale presenza di una miopia elevata.
Come si misura la pressione intraoculare?
Esistono diversi metodi: col passare degli anni la tecnica si è evoluta fino a raggiungere misurazioni più precise. Attualmente lo strumento più diffuso negli ospedali è il “tonometro ad applanazione” di Goldmann (con cui si esercita una pressione sulla cornea e si misura la resistenza del bulbo), mentre per gli screening di massa la tecnologia più diffusa è il “tonometro a soffio” (con cui non c’è contatto diretto perché si sfrutta un getto d’aria direzionato sulla cornea). (Vedi tonometria).
Quali possono essere altri esami utili?
Può essere utile misurare lo spessore corneale (attraverso un apposito esame strumentale che si chiama pachimetria), in modo da capire quale sia il valore “reale” della propria pressione oculare. In particolare, si è visto, che nelle persone che presentano una pachimetria più bassa (ossia una cornea sottile) si deve aumentare di alcuni punti la pressione oculare rilevata, così da ottenere una misurazione tonometrica corretta (reale); viceversa, negli individui con pachimetria più alta (cornea spessa), si devono sottrarre alcuni punti.
Quando bisogna effettuare la pachimetria?
È sufficiente eseguire la pachimetria corneale una sola volta, dal momento che lo spessore corneale non si modifica in maniera significativa nel tempo, a differenza di altri esami quali il campo visivo e altre valutazioni di eventuali danni provocati dal glaucoma.
Come si tratta il glaucoma?
Si cura di solito con colliri per abbassare la pressione oculare (detti “ipotonizzanti”). Per risultare efficace la terapia deve essere seguita regolarmente e con costanza.Talvolta, il trattamento può dar luogo ad effetti non desiderati: alcuni tipi di gocce possono causare bruciore, arrossamento dell’occhio e mal di testa, che di solito scompaiono dopo poche settimane. Talora si possono avere anche alterazioni di scarsa importanza del ritmo cardiaco. Chi accusa eventuali fastidi o disturbi dovrà sempre informare il medico oculista presso cui è in cura.
I glaucomatosi necessitano di controlli periodici. Questa malattia, infatti, può peggiorare senza che dia sintomi e, in tal caso, può essere necessario modificare il tipo di terapia. Una volta avvenuto il danno non è più reversibile: si ricorre a farmaci ed eventualmente alla chirurgia (trabeculectomia) per cercare di preservare almeno la funzionalità visiva residua.
Il trattamento del glaucoma è di solito efficace solo se viene seguita scrupolosamente la terapia prescritta dal medico oculista. Talvolta vengono prescritti integratori alimentari che potrebbero contribuire alla protezione del nervo ottico.
La terapia per il glaucoma non deve mai essere sospesa senza consultare prima l’oculista, ma anche il medico di famiglia deve essere sempre al corrente della terapia praticata. Se tale terapia non fosse efficace nel controllare la pressione intraoculare, potrebbe rendersi necessario il ricorso alla chirurgia o al laser. Le complicanze di tali interventi sono rare. Nella maggioranza dei casi si riesce, con questi metodi, ad impedire l’evoluzione della malattia che altrimenti – se la pressione oculare non si riduce – può portare a ipovisione e cecità.
Quand’è più probabile che una persona sia affetta da glaucoma?
Quando ha più di quarant’anni e ci sono altri casi in famiglia (per questo si parla di “familiarità” per il glaucoma). Più si è anziani e più aumenta il rischio di essere colpiti da questa patologia oculare detta anche “silente” perché non dà sintomi particolari nelle fasi iniziali. Soprattutto chi ha altri familiari con glaucoma dovrebbe sottoporsi indicativamente a un controllo oculistico una volta l’anno in assenza di altre patologie (con misurazione della pressione oculare). La maggiore incidenza di glaucoma sarebbe favorita anche dalla presenza di una miopia o di un’ipermetropia elevate, dal diabete e da eventuali terapie protratte a base di cortisonici.
Maculopatia
Cos’è la degenerazione maculare legata all’età (AMD o DMLE)?
La degenerazione maculare è una patologia che interessa la macula, la porzione centrale della retina, compromettendo progressivamente la visione centrale. Viene comunemente definita degenerazione maculare legata all’età (AMD o DMLE) poiché tende a manifestarsi prevalentemente in individui con più di 60 anni.
Quali sono le sue conseguenze?
La malattia determina una significativa e irreversibile riduzione della capacità visiva nella zona centrale del campo visivo. Il principale fattore scatenante è l’invecchiamento dell’occhio: la macula, ricca di fotorecettori (coni), subisce alterazioni che ne compromettono la funzione. Questo deterioramento è causato dalla graduale morte delle cellule retiniche, che può avvenire lentamente e in modo progressivo oppure in maniera più rapida e improvvisa.
Quanto è diffusa?
L’AMD rappresenta attualmente la principale causa di cecità centrale nei Paesi economicamente sviluppati e la terza a livello globale. Si stima che il 5% della cecità mondiale sia attribuibile a questa patologia, percentuale che nei Paesi più benestanti sale fino al 41%. Inoltre, è una delle principali cause di ipovisione.
Le proiezioni indicano che nel 2020 circa 196 milioni di persone siano state colpite dalla degenerazione maculare legata all’età, con una crescita destinata ad aumentare a causa dell’invecchiamento della popolazione, soprattutto nelle nazioni più ricche.
L’incidenza dell’AMD è rara prima dei 55 anni, ma diventa più frequente dopo i 75 anni. La forma più grave, nota come AMD umida, è meno diffusa ma caratterizzata da una progressione più rapida. Attualmente, è l’unica variante della malattia per la quale esistono trattamenti specifici.
Quali sono i sintomi della degenerazione maculare legata all’età?
I primi sintomi della degenerazione maculare possono includere la distorsione delle immagini nella parte centrale del campo visivo, ossia quella in cui si concentra lo sguardo. Altri segnali comuni sono la diminuzione dell’acuità visiva, difficoltà nella lettura e nello svolgimento di attività che richiedono una visione ravvicinata, come osservare i dettagli piccoli, e la necessità di un’illuminazione più intensa per vedere da vicino. Si può anche riscontrare una perdita di brillantezza nei colori, difficoltà nel riconoscere i volti delle persone e un’impossibilità nell’adattamento al buio.
La degenerazione maculare comporta una notevole limitazione visiva, ma è importante sottolineare che, anche nei casi più gravi, non porta alla cecità totale, poiché la visione periferica e laterale tende a essere preservata. Tuttavia, si tratta di una condizione invalidante, che può avere ripercussioni anche sul piano psicologico.
Cause della degenerazione maculare legata all’età (AMD)
L’eziologia dell’AMD non è ancora completamente chiara, ma sono stati identificati numerosi fattori di rischio associati alla sua comparsa. Tra i principali troviamo:
- Età superiore ai 55 anni
- Sesso (le donne sono maggiormente predisposte)
- Fumo di sigaretta
- Abuso di alcol
- Diabete mellito
- Sedentarietà
- Dieta povera di vitamine e acidi grassi, in particolare omega-3
- Ipertensione arteriosa
- Disturbi della coagulazione
- Esposizione prolungata e ripetuta a sorgenti di luce molto intense
Un altro fattore rilevante è la familiarità: è stato infatti dimostrato che i soggetti con parenti di primo grado affetti da AMD hanno un rischio maggiore di sviluppare la malattia, suggerendo una componente genetica.
Sono stati identificati anche alcuni fattori genetici che aumentano il rischio di sviluppare la maculopatia. I più noti sono i geni CFH e ARMS2. In particolare, una variante del gene CFH (denominata rs1061170) è stata associata a un rischio aumentato di almeno cinque volte di sviluppare la degenerazione maculare.
Inoltre, esistono test genetici, come il tampone orale, per stimare il rischio di sviluppare AMD. Tuttavia, la loro affidabilità è ancora limitata. Uno studio del 2012 ha individuato anche un meccanismo genetico che, aumentando l’espressione della proteina IL17RC nella retina, favorirebbe l’infiammazione della macula e l’attacco da parte delle cellule immunitarie, che danneggiano le cellule retiniche.
Classificazione della degenerazione maculare legata all’età (AMD)
La degenerazione maculare legata all’età (o degenerazione maculare senile) si manifesta in due forme principali, entrambe legate a un’alterazione del microcircolo capillare della macula, tipica dell’età avanzata:
- Forma secca (atrofica).
- Forma umida (essudativa).
Si tratta di due condizioni distinte, con prognosi e trattamenti completamente diversi.
Forma secca (atrofica) – 85-90% dei casi
È la forma più comune e si sviluppa lentamente. È caratterizzata da un progressivo assottigliamento della retina centrale, dovuto a un insufficiente apporto di nutrienti da parte dei capillari. Questo processo porta all’atrofia delle cellule nervose fotosensibili, con la formazione di una cicatrice maculare dall’aspetto caratteristico a “carta geografica” (areolare).
Forma umida (essudativa) – 10-15% dei casi
È la forma più aggressiva e a più rapida evoluzione. Si distingue per la formazione di nuovi capillari dalla parete fragile, che lasciano filtrare plasma (la parte liquida del sangue), provocando il distacco sieroso dell’epitelio pigmentato retinico. Nei casi più avanzati, questi vasi possono rompersi, causando emorragie retiniche. La ripetuta alternanza tra episodi emorragici e riparazione tissutale porta alla formazione di una cicatrice centrale che compromette gravemente la visione.
Le drusen: un segnale precoce dell’AMD
Entrambe le forme di AMD sono spesso associate alla presenza di drusen, depositi di materiale di scarto sotto la retina. Si distinguono due tipi principali:
- Hard drusen: di piccole dimensioni e meno pericolose.
- Soft drusen: più grandi e potenzialmente dannose per la vista.
Nella fase iniziale dell’AMD, caratterizzata dalla presenza di drusen, i sintomi possono essere assenti o lievi, con occasionali distorsioni delle immagini, in particolare delle linee rette (metamorfopsie).
Uno studio pubblicato su JAMA Ophthalmology il 2 aprile 2015 ha identificato due principali fattori di rischio per la progressione della malattia:
- L’età avanzata
- La mutazione di due alleli genetici (CFH e ARMS2)
In particolare, la presenza contemporanea di drusen di medie dimensioni e anomalie dell’epitelio pigmentato retinico aumenta significativamente il rischio di sviluppare AMD avanzata.
Diagnosi
La degenerazione maculare viene diagnosticata dall’oculista attraverso una visita completa. Lo specialista raccoglie l’anamnesi del paziente per valutare familiarità con la malattia e individuare l’insorgenza dei primi sintomi. Successivamente, misura l’acuità visiva (da lontano e da vicino) ed esegue l’esame del fondo oculare, osservando la macula e la retina periferica con un oftalmoscopio e lenti specifiche, dopo dilatazione pupillare. Le drusen appaiono come piccoli depositi giallastri.
Un test semplice e utile per monitorare la patologia nel tempo è il reticolo di Amsler, una griglia con un punto centrale che aiuta a rilevare distorsioni o zone cieche nel campo visivo. Uno dei sintomi tipici è la percezione distorta delle linee rette (ad esempio, le righe di un quaderno o le fughe delle piastrelle). In caso di tali alterazioni, è fondamentale sottoporsi tempestivamente a una visita oculistica.
Per approfondire la diagnosi, l’oculista può prescrivere esami strumentali come l’OCT (tomografia a coerenza ottica), l’angio-OCT, l’angiografia con fluoresceina (FAG) e l’angiografia al verde di indocianina (ICG). L’OCT permette di analizzare le alterazioni retiniche precoci e misurare lo spessore della retina; l’angio-OCT studia la rete vascolare senza mezzo di contrasto; le angiografie con fluoresceina e verde di indocianina forniscono immagini dettagliate della circolazione retinica e coroideale tramite un contrasto iniettato per via endovenosa.
Questi esami aiutano a confermare la diagnosi, monitorare la progressione della malattia e guidare eventuali trattamenti.
Trattamenti
L’approccio terapeutico varia a seconda che la degenerazione maculare sia di tipo secco o umido. Le forme secche, ad oggi, non hanno una cura definitiva, ma una diagnosi precoce può aiutare a rallentarne la progressione. Adottare uno stile di vita sano, con attività fisica regolare e un’alimentazione equilibrata, potrebbe offrire qualche beneficio, sebbene la questione resti scientificamente dibattuta. In alcuni casi, la forma secca può evolvere in quella umida.
Alcuni pazienti fanno uso di integratori alimentari a base di sostanze antiossidanti, potenzialmente utili per contrastare la formazione di radicali liberi e prevenire l’ischemia del tessuto retinico maculare (ossia la sua degenerazione dovuta alla riduzione del flusso sanguigno). Tra i più comuni figurano la luteina, le vitamine A ed E, i sali minerali (zinco, rame, selenio) e gli antiossidanti vegetali come la zeaxantina e l’astaxantina. Tuttavia, lo studio AREDS2 ha ridimensionato le aspettative sulla loro reale efficacia.
La Terapia Fotodinamica (PDT)
La forma umida (essudativa) della degenerazione maculare è stata trattata in passato con la terapia fotodinamica, sebbene oggi si preferiscano le iniezioni intravitreali di farmaci anti-VEGF. Questo trattamento prevede l’uso di un laser speciale, preceduto dalla somministrazione endovenosa di una sostanza fotosensibilizzante chiamata verteporfina.
Il laser consente l’occlusione selettiva dei nuovi vasi sanguigni anomali, favorendo la formazione di trombi che chiudono i capillari nocivi e contrastano la progressione della malattia. Se necessario, la terapia può essere ripetuta nel tempo in caso di recidive.
Le Iniezioni intravitreali
Attualmente, il trattamento di prima scelta per la maculopatia essudativa è rappresentato dalle iniezioni intravitreali di farmaci anti-VEGF. Queste sostanze inibiscono la proliferazione anomala di nuovi vasi sanguigni nella retina (azione antiangiogenica), responsabili della formazione di membrane sottoretiniche e sanguinamenti.
I principi attivi utilizzati includono pegaptanib sodico, bevacizumab, ranibizumab, aflibercept e brolucizumab. Questi farmaci permettono di ottenere buoni risultati nel trattamento delle degenerazioni maculari essudative, contribuendo a rallentare o bloccare la progressione della malattia e a stabilizzare la capacità visiva del paziente.
Le iniezioni devono essere somministrate in un ambiente sterile e ripetute per alcuni mesi per garantire l’efficacia del trattamento. In caso di mancata risposta o di indicazioni non adeguate, la terapia viene sospesa.
Ricerche scientifiche sui primi farmaci anti-VEGF per la maculopatia essudativa
Con l’introduzione dei primi farmaci anti-VEGF somministrati per via intravitreale, sono stati condotti studi per valutarne efficacia e sicurezza. Una ricerca pubblicata sul New England Journal of Medicine nel 2011 ha concluso che, dopo un anno di trattamento, bevacizumab e ranibizumab avevano effetti equivalenti sull’acuità visiva nei pazienti con AMD umida. Lo studio CATT (Comparison of Age-related Macular Degeneration Treatments Trials) ha confermato l’efficacia del ranibizumab e l’uso off-label del bevacizumab, pur in assenza di dati analoghi a supporto. In Italia, il bevacizumab può essere usato off-label.
Lo studio, condotto su 1208 pazienti, ha confrontato i due farmaci somministrati mensilmente o al bisogno. I risultati hanno mostrato un miglioramento medio di circa 8 lettere sull’ottotipo per entrambi i trattamenti mensili, mentre il ranibizumab ha portato a una maggiore riduzione dello spessore retinico centrale (196 µm contro 152-168 µm). La ricerca ha concluso che i due farmaci hanno effetti equivalenti sull’acuità visiva, ma le differenze negli eventi avversi gravi richiedono ulteriori studi.
Nel 2012, Ophthalmology ha pubblicato un aggiornamento dello stesso gruppo di ricerca, confermando che, dopo due anni, l’efficacia dei due farmaci rimaneva simile. Lo studio, condotto su 1107 pazienti, ha rilevato tassi simili di eventi gravi come ictus e infarto, sebbene il bevacizumab fosse associato a una percentuale più alta di effetti collaterali non specifici (40% contro 32% del ranibizumab). L’American Academy of Ophthalmology ha evidenziato che questi dati potrebbero essere influenzati dall’età media dei pazienti (80 anni), un gruppo con un’alta incidenza di malattie croniche e ricoveri.
Uno studio del 2013 su Ophthalmology ha ribadito che entrambi i farmaci sono efficaci nel preservare l’acuità visiva nei pazienti con AMD. Un’ulteriore ricerca pubblicata su Retina nel 2014 ha confermato l’equivalenza tra bevacizumab e ranibizumab in termini di acuità visiva, con una leggera superiorità anatomica del ranibizumab. Non sono state riscontrate differenze significative nei tassi di mortalità o eventi trombotici, ma ulteriori studi sono necessari per confermare questi risultati.
Evoluzione dei farmaci anti-VEGF
Il primo farmaco anti-VEGF approvato dalla FDA è stato il Pegaptanib nel 2004, ma la sua efficacia limitata ha portato all’adozione di molecole più performanti come Ranibizumab, Bevacizumab e Aflibercept. Il Ranibizumab si è dimostrato efficace nel mantenere l’acuità visiva con un buon profilo di sicurezza, mentre il Bevacizumab, più economico, viene usato come alternativa. Il trattamento prevede tre iniezioni mensili iniziali, seguite da somministrazioni secondo necessità.
L’Aflibercept, introdotto più recentemente, segue un regime simile ma con un successivo intervallo di otto settimane. Nel 2019 la FDA ha approvato il Brolucizumab, riconosciuto in Europa nel 2020, con un regime che prevede un’iniezione ogni 12 settimane dopo la fase iniziale.
Nel 2022 la Commissione Europea ha approvato il Faricimab per l’AMD umida, con quattro iniezioni mensili iniziali e successiva personalizzazione della terapia ogni 8, 12 o 16 settimane in base alla risposta del paziente.
Prospettive future di trattamento dell’AMD
Le future terapie potrebbero basarsi su studi genetici e sull’impiego di cellule staminali riprogrammate, con il potenziale di rigenerare la retina, come dimostrato da risultati promettenti negli USA per l’AMD secca.
Altri approcci mirano alla rimozione degli accumuli proteici dannosi per la retina (drusen) tramite meccanismi di autofagia, sebbene siano necessari ulteriori studi. Data la complessità dell’AMD, specialmente nella forma secca, una cura risolutiva resta difficile da sviluppare.
Sul fronte riabilitativo, la tecnica del biofeedback, basata sulla fotostimolazione retinica, sta mostrando buoni risultati nel migliorare la fissazione e l’acuità visiva. Utili anche gli ausili per ipovedenti, come i videoingranditori disponibili in diversi centri ospedalieri.
La diagnosi precoce è essenziale per attuare strategie preventive efficaci, ma è importante che i pazienti siano consapevoli della natura degenerativa della malattia e delle possibili limitazioni delle terapie disponibili.
Uno stile di vita corretto: alimentazione varia, niente fumo e più esercizio fisico
L’aumento dei casi di degenerazione maculare legata all’età (AMD) ha portato a numerosi studi sul ruolo dello stile di vita nella prevenzione della malattia.
Smettere di fumare è la prima buona pratica: il fumo triplica il rischio di AMD. Inoltre, è fondamentale monitorare la salute cardiovascolare con controlli regolari.
L’esercizio fisico moderato è consigliato a tutte le età, poiché studi indicano che chi lo pratica regolarmente ha un rischio minore di sviluppare AMD o di vederne una progressione più rapida.
Anche la protezione dai raggi ultravioletti è essenziale. L’esposizione prolungata può danneggiare la macula, soprattutto in presenza di familiarità per AMD. Per questo, è importante utilizzare occhiali da sole con lenti a norma di legge per ridurre il rischio.
Occhio secco
La sindrome dell’occhio secco può essere risolta con la luce pulsata IRPL, una tecnica che ripristina il funzionamento delle ghiandole di Meibomio. La sindrome dell’occhio secco è una delle condizioni oculari più comuni a livello globale e interessa circa il 20% della popolazione italiana. Può presentarsi a qualsiasi età, ma diventa più frequente con l’avanzare degli anni. Questa problematica è causata da una scarsa lubrificazione della superficie oculare, dando origine a sintomi come bruciore, prurito e visione offuscata, con un impatto significativo sulla qualità della vita. Le numerose cause alla base dell’occhio secco rendono necessario un approccio mirato per una gestione efficace.
La sindrome dell’occhio secco si presenta in diverse tipologie. La deficienza muco-acquosa può manifestarsi nella forma Sjögren, collegata a una patologia autoimmune che compromette la produzione di lacrime, oppure nella forma non-Sjögren, associata a malattie come lupus eritematoso sistemico, artrite reumatoide e sclerodermia. Quest’ultima può anche derivare da ostruzioni del dotto lacrimale, riduzione del riflesso lacrimale o dall’uso di farmaci sistemici. La forma evaporativa, la più comune, è causata dalla disfunzione delle ghiandole di Meibomio, responsabili della produzione dello strato lipidico protettivo del film lacrimale. Infine, esiste una forma mista che combina le caratteristiche delle due precedenti.
I sintomi della sindrome dell’occhio secco variano in base alla tipologia e alla gravità della condizione. Nella forma evaporativa si manifestano:
- Bruciore e sensazione di corpo estraneo negli occhi;
- Visione intermittente offuscata, soprattutto dopo un uso prolungato di dispositivi digitali.
Nella forma da deficienza muco-acquosa si osservano:
- Riduzione della produzione di lacrime e difficoltà a mettere a fuoco;
- Visione sfocata e discomfort oculare, con un aumento del rischio di irritazioni e infezioni.
La forma mista può presentare fotofobia, lacrimazione eccessiva dovuta all’irritazione oculare, affaticamento visivo, mal di testa e tensione muscolare intorno agli occhi. I sintomi tendono a peggiorare in ambienti secchi o climatizzati, con vento, fumo o polveri, e possono compromettere attività quotidiane come la guida notturna o l’uso prolungato di schermi.
Le cure per l’occhio secco variano in base alla tipologia e alla gravità della patologia. Nei trattamenti iniziali si consiglia l’uso di colliri lubrificanti o gel oftalmici, la sospensione delle lenti a contatto e un miglioramento della dieta con un maggior apporto di Omega-3, frutta e verdura. È utile anche eliminare fattori irritanti come fumo, alcol e caffeina, oltre a ridurre l’affaticamento visivo.
Per la forma evaporativa, trattamenti avanzati come la luce pulsata IRPL e il LipiFlow possono stimolare le ghiandole di Meibomio e migliorare la qualità del film lacrimale. Nella forma da deficienza muco-acquosa, invece, non esistono ancora terapie in grado di stabilizzare in modo duraturo la produzione lacrimale.
La luce pulsata IRPL rappresenta un trattamento innovativo per la forma evaporativa, in quanto utilizza impulsi luminosi per stimolare le ghiandole di Meibomio, migliorando la qualità del film lacrimale. Ogni seduta dura pochi minuti ed è indolore, con benefici visibili già dalla seconda sessione. Il protocollo prevede 3-4 sedute, con richiami semestrali o annuali a seconda della gravità della condizione.
Secondo gli studi clinici, l’85 percento dei pazienti riscontra un miglioramento significativo, con effetti che durano oltre tre anni nel 60 percento dei casi.
OFTALMOPLASTICA
Blefaroplastica
La blefaroplastica è un intervento di chirurgia estetica che aiuta a ridare freschezza allo sguardo, eliminando i segni dell’età. L’obiettivo principale è mantenere l’equilibrio complessivo del viso, tenendo conto dell’importanza dello sguardo, che gioca un ruolo fondamentale nell’estetica del volto. L’invecchiamento dei tessuti oculari e perioculari contribuisce a un aspetto stanco e invecchiato, motivo per cui una visita oculoplastica è essenziale per definire le indicazioni chirurgiche e ottenere risultati sicuri e soddisfacenti.
L’anatomia delle palpebre è complessa e ogni paziente ha caratteristiche uniche che devono essere considerate per offrire risultati personalizzati. Elementi come la forma e posizione delle sopracciglia, la piega palpebrale, la profondità del solco e la quantità di pelle in eccesso sono determinanti per il successo dell’intervento. Durante la consulenza, ascolto attentamente le richieste del paziente e mostro una simulazione del risultato post-operatorio, per assicurarmi che le aspettative siano realistiche e che l’intervento sia adatto al caso.
Con l’invecchiamento, la tonicità dei tessuti e la forma delle palpebre cambiano, e fattori come l’esposizione al sole e la predisposizione genetica possono rendere lo sguardo più stanco. La chirurgia consente di rimuovere l’eccesso di pelle, grasso e muscoli che hanno perso elasticità, ripristinando un aspetto più giovane e fresco.
Nel caso della palpebra superiore, l’intervento di blefaroplastica superiore corregge la blefarocalasi, ovvero l’eccesso di pelle dovuto alla gravità e ai movimenti ripetitivi delle palpebre. L’incisione avviene nella piega naturale della palpebra, risultando invisibile già dai primi giorni, con una guarigione che porta alla scomparsa della cicatrice.
Blefaroplastica inferiore
La pelle in eccesso nelle palpebre inferiori è una condizione che colpisce la maggior parte dei pazienti. Questo inestetismo, che può manifestarsi sotto forma di rughe e lassità cutanea, è spesso corretto tramite interventi chirurgici. La rimozione della pelle in eccesso è fondamentale per migliorare l’aspetto e ottenere un risultato più giovane e fresco.
Una delle tecniche più utilizzate per questo tipo di intervento è l’Eyed Lift, che prevede due fasi principali. La prima fase consiste nell’asportare una piccola porzione di pelle, un “mini pinch”, in modo preciso e delicato. La quantità di pelle da rimuovere è determinata dalla sospensione dell’orbicolare, che permette di intervenire in sicurezza. Questa tecnica consente di rimuovere la pelle in eccesso senza alterare la forma dell’occhio o rischiare complicazioni come la distorsione del contorno o l’apertura eccessiva dell’occhio.
La blefaroplastica inferiore è una chirurgia estetica che corregge le anomalie delle palpebre inferiori, che possono presentarsi singolarmente o in combinazione tra loro, dando luogo a un inestetismo complesso. Le borse adipose, che si formano con l’età, sono una delle anomalie più comuni. Queste borse, note anche come ernie adipose, alterano il contorno naturale della palpebra. La loro formazione può iniziare già a partire dai 30 anni e progredire con il passare del tempo, diventando più evidenti.
La visita oculoplastica è fondamentale per valutare la condizione delle palpebre inferiori e la posizione del grasso. Durante la visita, si esamina l’entità dell’eccesso cutaneo, la presenza delle borse adipose e altre caratteristiche come eventuali pieghe visibili nel solco delle lacrime o borse malari (pieghe cutanee sotto lo zigomo). La combinazione di queste problematiche può rendere il quadro estetico molto complesso, ma una corretta diagnosi consente di scegliere la tecnica chirurgica più adatta.
Nel caso di erniazione isolata del grasso, una delle tecniche più efficaci è la blefaroplastica trans-congiuntivale. Questa tecnica consente di rimuovere il grasso in eccesso senza lasciare cicatrici visibili, poiché l’accesso avviene attraverso l’interno della palpebra. Questo approccio riduce notevolmente il rischio di complicazioni, come l’ectropion (retraito della palpebra inferiore), che può verificarsi in caso di rimozione eccessiva di pelle. In alcuni casi, anziché rimuovere completamente il grasso, si può scegliere di riposizionarlo per riempire il solco delle lacrime, una zona che con l’età tende a svuotarsi e a formare occhiaie.
Quando, oltre all’eccesso di grasso, è presente anche un lieve eccesso di pelle, si opta per un intervento più invasivo, ma sempre sicuro, che prevede un’incisione sotto le ciglia. In questo caso, si solleva la palpebra e la parte superiore della guancia, correggendo anche le pieghe cutanee. Questa tecnica, chiamata SOOF lifting o lifting malare, consente di rimuovere l’eccesso cutaneo in sicurezza e riposizionare i tessuti in modo naturale, migliorando anche le rughe nella zona.
La blefaroplastica inferiore, grazie alla sua versatilità e alle diverse tecniche disponibili, è in grado di ottenere risultati estetici molto naturali e soddisfacenti. I rischi associati all’intervento sono limitati e, con la giusta tecnica, è possibile ottenere un effetto di ringiovanimento duraturo fino a 10 anni.
L’esperienza e la competenza di un chirurgo oculoplastico sono cruciali per eseguire un intervento sicuro e personalizzato. La chirurgia delle palpebre inferiori è una delle più richieste e, grazie alla personalizzazione della tecnica in base al difetto estetico, i risultati possono essere ottimali per ogni paziente. Che si tratti di rimuovere il grasso in eccesso, riposizionarlo o intervenire sull’eccesso di pelle, la blefaroplastica inferiore è un intervento efficace e sicuro per chi desidera migliorare l’aspetto della zona perioculare.
Blefaroplastica – rischi
La blefaroplastica è un intervento chirurgico che, se eseguito correttamente, ha un rischio molto basso di complicanze, ma è importante affidarsi a chirurghi esperti, preferibilmente oculisti, per ridurre al minimo i rischi e ottenere un risultato estetico ottimale. La tecnica deve essere altamente personalizzata, tenendo conto delle specifiche esigenze di ogni paziente.
Palpebre Superiori
La chirurgia delle palpebre superiori ha come obiettivo la rimozione dell’eccesso di pelle e grasso che può rendere lo sguardo stanco e appesantito. Tuttavia, se la pelle viene rimossa in modo eccessivo, potrebbe compromettere la corretta chiusura della palpebra, causando lagoftalmo notturno, un disturbo che porta alla secchezza oculare, rossore, fotofobia e a un’esposizione continua della cornea. È essenziale garantire che almeno 18 mm di pelle siano lasciati tra le ciglia e il sopracciglio per mantenere la funzionalità della palpebra. Inoltre, è fondamentale evitare di rimuovere troppo muscolo orbicolare, per non compromettere la capacità di chiusura della palpebra stessa. Il rispetto dell’anatomia complessa delle palpebre superiori è quindi essenziale. A livello estetico, la simmetria tra le palpebre e la corretta esecuzione della piega palpebrale sono cruciali per un risultato naturale. Infine, una valutazione preliminare della secchezza oculare e della salute corneale deve essere eseguita per evitare complicazioni post-operatorie.
Palpebre Inferiori
La chirurgia delle palpebre inferiori, che si occupa principalmente dell’eliminazione di borse sotto gli occhi, presenta rischi e complicazioni maggiori rispetto alle palpebre superiori, soprattutto a causa dell’effetto della gravità. Il rischio principale è l’ectropion cicatriziale, un problema che si verifica quando la palpebra inferiore si ribalta, causando difficoltà nel richiudere l’occhio e problemi di secchezza oculare e irritazione. Questo può essere evitato solo con una tecnica chirurgica accurata e personalizzata. Inoltre, la rimozione eccessiva di pelle o grasso può accentuare le occhiaie o causare una pelle troppo tirata, peggiorando l’aspetto estetico. La tecnica migliore per pazienti più giovani con poco eccesso di pelle è la chirurgia trans-congiuntivale, che rimuove solo il grasso in eccesso senza incidi sulla pelle, o il lifting del SOOF, che agisce sui muscoli e grassi per risollevare la palpebra inferiore. Se l’intervento rimuove troppo grasso, i pazienti potrebbero presentare occhiaie evidenti, che richiederebbero correzioni tramite filler o lipofilling, che ripristinano il volume perso nella zona sotto gli occhi.
Blefaroplastica – complicazioni
La blefaroplastica è generalmente un intervento sicuro, con un basso rischio di complicanze, quando eseguito correttamente da un chirurgo esperto. Tuttavia, negli ultimi tempi, si osserva un aumento di operazioni fatte da medici con poca esperienza nella regione oculare, il che ha portato a un incremento delle complicazioni.
Complicazioni delle palpebre inferiori
Le complicazioni sono più frequenti sulle palpebre inferiori, poiché sono più soggette alla gravità e anche piccoli errori possono compromettere gravemente il risultato estetico. La rimozione eccessiva di pelle può causare un abbassamento della palpebra, creando un effetto indesiderato di occhio tondo con esposizione della sclera (il bianco dell’occhio) tra la parte colorata e il bordo superiore della palpebra.
Complicazioni delle palpebre superiori
Le palpebre superiori hanno un rischio minore di complicazioni, ma l’eccessiva rimozione di pelle può impedire la corretta chiusura delle palpebre, provocando lagoftalmo notturno, che porta a secchezza oculare, rossore e fotofobia (fastidio alla luce). Inoltre, una blefaroplastica troppo invasiva può danneggiare il muscolo elevatore della palpebra superiore, causando ptosi palpebrale (abbassamento della palpebra). Se il chirurgo non riconosce una ptosi pre-esistente, questa potrebbe risultare più evidente dopo l’intervento.
Calazio
Cos’è il calazio?
Il calazio è una neoformazione causata dall’infiammazione delle ghiandole di Meibomio, che si trovano nelle palpebre e contribuiscono alla produzione delle lacrime. Di solito appare come una piccola pallina bianca, visibile ad occhio nudo o palpabile al tatto.
Sintomi
I sintomi includono gonfiore, dolore e arrossamento della congiuntiva. La gravità dipende dall’infiammazione e dal numero di ghiandole coinvolte. Il calazio può variare in dimensioni, da una piccola pallina a un gonfiore che può chiudere la palpebra.
Cause
Il calazio è spesso legato a una dieta squilibrata, ricca di cibi grassi, dolci e insaccati. Nei bambini, può derivare da difetti visivi non corretti, che causano la chiusura del dotto escretore, impedendo il normale drenaggio delle ghiandole. Fattori genetici, costituzionali e psicologici, come ansia e blefariti, possono anch’essi contribuire.
Calazio nei bambini
Nei bambini, i calazi sono comuni, soprattutto a causa della scarsa igiene oculare, dovuta al toccarsi gli occhi con le mani sporche. Una dieta ricca di zuccheri e grassi può anche predisporre alla loro formazione. Rimedi naturali, come impacchi caldo-umidi, possono essere utili, ma se il calazio persiste, è necessario consultare un oculista per terapie specifiche.
Rimedi e cure
Una dieta sana e l’uso di fermenti lattici possono favorire la guarigione. È utile un delicato massaggio della palpebra gonfia, eseguito 2-3 volte al giorno, per rimuovere l’ostruzione del dotto ghiandolare. Pomate antibiotiche o antibiotico-cortisoniche devono essere prescritte dal medico. Impacchi caldo-umidi, se indicati, possono essere fatti due volte al giorno. È importante anche correggere eventuali difetti visivi per prevenire il calazio.
Cosa evitare
Evitare impacchi troppo caldi e non spremere il calazio, per non aggravare l’infiammazione. Nei casi di calazio multiplo, è sconsigliato l’uso di trucco o lenti a contatto.
Fake news
Non tentare mai di far scoppiare o pungere il calazio per drenarlo, poiché può provocare infezioni.
Durata e intervento
Il calazio scompare generalmente in 7-10 giorni. Se persiste, potrebbe formarsi una “capsula” e richiedere un intervento chirurgico per asportare la ghiandola. Il trattamento chirurgico è indicato quando il calazio non regredisce o causa disturbi significativi. In alcuni casi, il calazio può ripresentarsi, e in tal caso è utile indagare cause sistemiche con l’oculista.
Calazio e orzaiolo
Sebbene entrambi causino gonfiore e arrossamento, il calazio è dovuto all’infiammazione delle ghiandole di Meibomio, mentre l’orzaiolo è causato da un’infiammazione batterica delle ghiandole di Zeiss. Il calazio di solito è meno doloroso rispetto all’orzaiolo.
Chirurgia dello sguardo
La chirurgia oculoplastica estetica si concentra esclusivamente sul ringiovanimento della zona dello sguardo, un elemento fondamentale per l’armonia dell’intero volto.
Analizzando i segni dell’invecchiamento in quest’area, il chirurgo oculoplastico è in grado di intervenire sulla parte superiore del viso, correggendo il rilassamento dei tessuti di fronte, sopracciglia e palpebre superiori, e sulla parte inferiore, migliorando le variazioni di volume che interessano palpebre inferiori, guance e zigomi.
A seconda delle esigenze del paziente, il grasso palpebrale può essere rimosso o riposizionato attraverso un approccio transcongiuntivale. Inoltre, il lipofilling permette di ripristinare i volumi e migliorare la qualità della pelle, ottenendo un effetto più naturale e armonioso.
Essendo un’area chiave per l’estetica del volto, la figura più indicata per questi interventi è il chirurgo plastico oculo-facciale, specializzato nelle tecniche più avanzate per il ringiovanimento perioculare e facciale.
Questo specialista ha una conoscenza approfondita di procedure come il lifting endoscopico, la blefaroplastica superiore, la blefaroplastica inferiore transcongiuntivale, il lipofilling, la cantoplastica e la cantopessi, garantendo risultati personalizzati e in linea con le caratteristiche del paziente.
Oltre a eseguire interventi estetici, il chirurgo oculo-facciale si occupa anche della correzione di eventuali complicanze derivanti da precedenti procedure, ripristinando la naturale armonia dello sguardo.
Entropion
L’entropion palpebrale è una condizione in cui il margine ciliare della palpebra inferiore si ripiega verso l’interno, entrando in contatto con la superficie oculare. Questo disturbo, che interessa esclusivamente la palpebra inferiore, può manifestarsi su un solo lato o su entrambi.
La principale conseguenza è lo sfregamento delle ciglia contro la cornea, la parte più sensibile dell’occhio, provocando fastidio, arrossamento, dolore e lacrimazione. Il problema deriva dal cedimento del tendine cantale laterale e dalla disinserzione dei muscoli retrattori della palpebra, che, insieme alla contrazione del muscolo orbicolare, causano il rovesciamento della palpebra verso l’interno.
Se non trattato, l’entropion può portare a complicanze più serie, come infiammazioni e infezioni corneali, che nei casi più gravi possono compromettere la salute dell’occhio. Inizialmente, il disturbo si manifesta in modo intermittente e il paziente riesce a riposizionare manualmente la palpebra. Tuttavia, con il tempo, la condizione tende a stabilizzarsi, rendendo inefficaci rimedi temporanei come l’applicazione di cerotti.
Trattamento dell’entropion
L’unico trattamento risolutivo per l’entropion è l’intervento chirurgico, che, pur essendo delicato, risulta poco invasivo per il paziente e garantisce un’elevata percentuale di successo a lungo termine. La procedura prevede la correzione delle cause del problema: la cantoplastica laterale per ripristinare la giusta tensione della palpebra e la reinserzione dei muscoli retrattori permettono di riportare il margine palpebrale nella posizione corretta, senza lasciare cicatrici visibili.
Ectropion
Con l’avanzare dell’età, anche le palpebre inferiori subiscono cambiamenti dovuti all’indebolimento di tendini e legamenti che ne garantiscono il corretto posizionamento. Il cedimento della palpebra inferiore con il suo rovesciamento verso l’esterno è noto come ectropion, un termine di origine greca. La principale causa di questa condizione è la perdita di tonicità del tendine cantale laterale, che normalmente assicura l’aderenza della palpebra inferiore al bulbo oculare grazie alla sua connessione con l’osso della rima orbitaria. Quando il tendine si indebolisce, la forza di gravità e il peso del bulbo oculare spingono la palpebra verso il basso e all’esterno.
Inizialmente, il primo segnale di ectropion è il rovesciamento del puntino lacrimale inferiore, che smette di drenare correttamente le lacrime, causando un’eccessiva lacrimazione. Con il progredire della condizione, la palpebra perde sempre più contatto con il bulbo oculare, esponendo la sua superficie interna, di colore rosa-rossastro, che normalmente rimane nascosta. Questo porta a sintomi come arrossamento, sensazione di corpo estraneo, irritazione e lacrimazione persistente.
Trattamento dell’ectropion
Attualmente non esistono terapie farmacologiche in grado di correggere questa problematica, e la sua evoluzione tende a peggiorare con l’invecchiamento dei tessuti. L’uso di colliri e creme oculari può alleviare i sintomi, ma nella maggior parte dei casi non rappresenta una soluzione definitiva. La buona notizia è che la chirurgia dell’ectropion senile è un intervento semplice ed estremamente efficace. La procedura viene eseguita in anestesia locale, in regime di day hospital, e garantisce un alto livello di soddisfazione per il paziente.
L’intervento prevede generalmente una cantoplastica laterale, che permette di riposizionare il bordo palpebrale. Nei casi in cui il puntino lacrimale sia evertito, si può associare la rimozione di una piccola porzione di congiuntiva (tecnica del medial spindle) per ripristinarne la corretta funzionalità. La combinazione di queste due tecniche richiede meno di mezz’ora, non comporta dolore e non lascia cicatrici visibili.
Neoformazioni oculari - Xantelasmi
Gli xantelasmi palpebrali sono accumuli di grasso che si formano sulla pelle intorno agli occhi, spesso in entrambi gli occhi contemporaneamente, e possono comparire sia sulla palpebra superiore che inferiore.
Possono essere rimossi con diversi trattamenti, a seconda delle dimensioni: intervento chirurgico per quelli più grandi, trattamenti laser per quelli di minori dimensioni. Sebbene non siano dannosi, le lesioni appaiono giallastre e la loro presenza potrebbe indicare disturbi metabolici, eccesso di lipidi nel sangue, malattie cardiache o persino tumori. Quando si verificano lontano dagli occhi, sono noti come xantomi.
Chi colpiscono?
Gli xantelasmi possono interessare chiunque, ma sono più comuni tra:
- Donne di età compresa tra 30 e 50 anni;
- Persone di etnia asiatica o mediterranea;
- Fumatori;
- Chi soffre di obesità, ipertensione o diabete.
Uno stile di vita con alimentazione ricca di grassi saturi, alcol e scarsa attività fisica aumenta il rischio di svilupparli.
Cause
Gli xantelasmi sono spesso causati da disturbi nei lipidi, in particolare da patologie che alzano i livelli di lipidi nel sangue. La causa più comune è l’ipercolesterolemia familiare, un’alterazione genetica che impedisce al corpo di gestire correttamente il colesterolo. Alcuni farmaci, come betabloccanti, contraccettivi orali, farmaci a base di estrogeni e corticosteroidi, possono anche causare xantelasmi.
Malattie associate
Le malattie che elevano i lipidi nel sangue e sono associate agli xantelasmi includono:
- Ipotiroidismo;
- Cirrosi biliare ed epatica;
- Pancreatite;
- Diabete;
- Malattie renali.
Sintomi
Gli xantelasmi non causano sintomi specifici, ma si manifestano come lesioni che crescono rapidamente, diventando antiestetiche. Nonostante l’aspetto, sono escrescenze benigne.
Diagnosi
Il medico di solito diagnostica gli xantelasmi esaminando la pelle e osservando i depositi di grasso. Per confermare la diagnosi, possono essere necessari esami del sangue per verificare i livelli di lipidi, come colesterolo totale, HDL, LDL e trigliceridi.
Trattamento
I trattamenti per rimuovere gli xantelasmi includono:
- Rimozione chirurgica per quelli più grandi (oltre 3 mm);
- Peeling chimico per lesioni poco profonde;
- Crioterapia con azoto liquido;
- Chirurgia laser (CO2 o argon);
- Cauterizzazione chimica con acidi acetici clorurati.
Per xantelasmi di piccole dimensioni, si consiglia di evitare interventi chirurgici a causa del tempo di cicatrizzazione, che può durare fino a quattro settimane. Inoltre, esiste il rischio che lo xantelasma si riformi, per cui è utile mantenere una dieta povera di grassi.
Ptosi
Ptosi palpebrale: qual è la differenza tra ptosi palpebrale e pelle cadente?
La ptosi palpebrale si verifica quando il bordo della palpebra superiore si abbassa sull’occhio, arrivando in alcuni casi a coprirlo parzialmente o completamente, con possibili ripercussioni sulla vista. Al contrario, la pelle cadente è semplicemente un eccesso cutaneo sulla palpebra, che raramente compromette la funzione visiva. È importante distinguere queste due condizioni, poiché possono manifestarsi contemporaneamente e richiedono approcci diagnostici e terapeutici differenti.
Ptosi palpebrale: quanti tipi ne esistono?
Si possono distinguere principalmente tre forme di ptosi:
- Ptosi congenita, presente fin dalla nascita.
- Ptosi involutiva, la più comune, che compare con l’invecchiamento a causa del rilassamento dei tessuti.
- Ptosi secondaria a patologie muscolari, legata a malattie che influenzano il funzionamento dei muscoli palpebrali.
Ptosi palpebrale: quale intervento viene eseguito?
La scelta dell’intervento dipende strettamente dal tipo di ptosi diagnosticata. Ogni forma ha una procedura chirurgica specifica, quindi una corretta diagnosi è essenziale per garantire un trattamento efficace e personalizzato.
Ptosi palpebrale: a chi rivolgersi per il trattamento?
L’esperto più indicato è il chirurgo oculoplastico, specializzato in interventi di estrema precisione che richiedono un’attenzione millimetrica ai dettagli. Il successo dell’intervento dipende in larga parte dall’esperienza dell’operatore, rendendo la scelta dello specialista un fattore cruciale per ottenere risultati ottimali.
Ptosi palpebrale: quali risultati si possono ottenere?
La correzione chirurgica della ptosi palpebrale offre generalmente ottimi risultati, con un effetto naturale, simmetrico e duraturo nel tempo.
Ptosi palpebrale: è possibile abbinarla ad altri interventi estetici?
Sì, è comune associare la correzione della ptosi ad altri interventi estetici per ottimizzare sia la funzionalità che l’estetica dello sguardo. I due interventi più frequentemente combinati sono:
- Blefaroplastica superiore e inferiore, che migliora l’aspetto delle palpebre e completa il risultato della correzione della ptosi.
- Cantoplastica o cantopessi, utile soprattutto nei casi congeniti, in cui la ptosi è accompagnata da un abbassamento della palpebra inferiore. Correggere entrambe le condizioni consente di ottenere un risultato più armonioso e naturale.
Tumori
L’esposizione prolungata al sole, soprattutto nei soggetti con capelli chiari, occhi azzurri e pelle chiara, è la principale causa dell’insorgenza dei tumori della pelle delle palpebre (tumori palpebrali).
Il tumore più comune in questo caso è il basalioma, o epitelioma basocellulare, che solitamente si sviluppa all’angolo interno dell’occhio (tra occhio e naso) o sulla palpebra inferiore.
Il basalioma si caratterizza per una crescita lenta e indolore, motivo per cui molti pazienti si rivolgono al medico solo quando la condizione è già avanzata.
Questo tipo di tumore ha una malignità bassa o locale, il che significa che raramente è pericoloso per la vita, ma può risultare pericoloso per l’occhio, poiché tende a danneggiare il tessuto sano circostante e a estendersi nel tempo.
La sua pericolosità aumenta se invade i tessuti oculari o orbitali, in quanto a quel punto non è più possibile intervenire con tecniche semplici, ma è necessaria una chirurgia molto più invasiva.
Trattamento
È fondamentale confermare il sospetto clinico attraverso una biopsia, per accertare la natura della lesione prima di procedere con interventi di rimozione e ricostruzione.
La cura definitiva del basalioma prevede un intervento chirurgico radicale, con asportazione totale del tumore e verifica dei margini di tessuto palpebrale circostanti per assicurarsi che non siano contaminati da cellule tumorali (tramite controllo istologico dei margini).
La ricostruzione del difetto avviene contemporaneamente alla rimozione del tumore e dipende dalle dimensioni del difetto residuo.
Il chirurgo oculoplastico è l’esperto più adatto per eseguire le tecniche di ricostruzione palpebrale, garantendo il miglior risultato estetico possibile e mantenendo la corretta funzionalità della palpebra.
VISITA ORTOTTICA

Cos’è?
Consiste nella valutazione specialistica neuro muscolare dell’apparato visivo sia del bambino che dell’adulto, volta a individuare alterazioni del sistema visivo-motorio e indagare disturbi legati alla vista.
Questa particolare visita viene eseguita da personale appositamente formato, ovvero i dottori in Ortottica o semplicemente Ortottisti.
Perché farla?
Serve ad evidenziare disturbi della motilità degli occhi, strabismo, visione sdoppiata, occhio pigro, o più correttamente ambliopia.
Quando farla?
Se si riscontrano particolari segni o atteggiamenti di non coordinamento del lattante dopo i 6 mesi di vita
Una prima valutazione in assenza di familiarità o di dubbi del pediatra al TERZO e SESTO anno, per la prevenzione della Ambliopia.
in tutti i casi in cui si rileva:
- Nistagmo o movimenti involontari degli occhi
- strabismo manifesto
- atteggiamenti viziati del capo ( ovvero quando il bambino storce la testa per fissare un oggetto).
É molto importante sottoporre il bambino a questo tipo di valutazione prima che danni funzionale come per esempio l’ambliopia possano istaurarsi definitivamente. Infatti bisogna tenere presente che l’apparato visivo del bambino ha delle tappe di sviluppo limitate nel tempo e questi difetti vanno riconosciuti e corretti il prima possibile, possibilmente prima dell’età scolare.
Presso lo Studio Medico Tergeste puoi eseguire la visita ortottica per il tuo bambino con la Dott.ssa Francesca Malannino già ortottista all’ IRCCS Burlo Garofolo di Trieste

